Neils Bohr
Biografía
Nació y murió en Copenhague (1885 – 1962), hijo de Christian Bohr y Ellen Adler. Tras doctorarse en la Universidad de Copenhague (1911) e intentar la ampliación de estudios en el Cavendish Laboratory de Cambridge con el químico John Thomson, completó sus estudios en Manchester, teniendo como maestro a Ernest Rutherford, con el que estableció una duradera relación científica y amistosa. En 1916, Bohr comenzó a ejercer como profesor de física teórica en la Universidad de Copenhague, consiguiendo los fondos para crear el Instituto Nórdico de Física Teórica, que dirigió desde 1920 hasta su fallecimiento. En 1943, con la Segunda Guerra Mundial,Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó el desarrollo de armas atómicas y trabajó para ello en el Proyecto Manhattan de Los Álamos, Nuevo México. Bohr es conocido por realizar importantes contribuciones para la comprensión de la estructura del átomo y fue ganador del Premio Nobel de Física de 1922.
Modelo atómico de Bohr
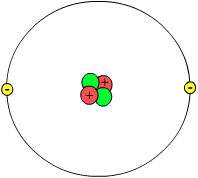
Fue propuesto en 1913 para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo y por qué los átomos presentaban espectros de emisión característicos. Neils se basó en el átomo de hidrógeno para crear este modelo. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción que se observan en los gases. Describió el átomo con un núcleo donde están los protones y los neutrones, y los electrones girando alrededor del núcleo en unas órbitas concretas. Según Bohr, los electrones pueden “saltar” de una órbita a otra aportándole energía.

Fallos del modelo atómico de Bohr
►El principal fallo fue creer que los electrones se situaban en unas órbitas fijas.
►Esta teoría solo puede aplicarse a átomos hidrogenoides, es decir que solamente tengan un electrón en su corteza.
►Por otra parte, en el modelo atómico de Bohr se encuentran conviviendo de forma un tanto artificial la Mecánica Clásica y la Mecánica Cuántica, esto hace que los nuevos números cuánticos que van apareciendo lo hacen un poco forzados por los resultados experimentales.


No hay comentarios:
Publicar un comentario
Nota: solo los miembros de este blog pueden publicar comentarios.